Τα στοιχεία μπορούν να ταξινομηθούν ως ένα από τα δύο μέταλλα ή μη μέταλλα με βάση τις ιδιότητές τους. Τις περισσότερες φορές, μπορείτε να πείτε ότι ένα στοιχείο είναι ένα μέταλλο απλά κοιτάζοντας τη μεταλλική λάμψη του, αλλά αυτή δεν είναι η μόνη διάκριση μεταξύ αυτών των δύο γενικών ομάδων στοιχείων.
Μέταλλα
Τα περισσότερα στοιχεία είναι μέταλλα. Αυτό περιλαμβάνει τα αλκαλικά μέταλλα, τα μέταλλα αλκαλικών γαιών, τα μεταβατικά μέταλλα, τα λανθανίδια και τα ακτινίδια. Στο Περιοδικός Πίνακας, τα μέταλλα διαχωρίζονται από τα μη μέταλλα με μια γραμμή ζιγκ-ζαγκ που διέρχεται από άνθρακα, φώσφορο, σελήνιο, ιώδιο και ραδόνιο. Αυτά τα στοιχεία και εκείνα στα δεξιά τους είναι μη μέταλλα. Στοιχεία ακριβώς στα αριστερά της γραμμής μπορούν να χαρακτηριστούν μεταλλοειδή ή ημιμετάλια και έχουν ιδιότητες ενδιάμεσες μεταξύ εκείνων των μετάλλων και των μη μετάλλων. Οι φυσικές και χημικές ιδιότητες των μετάλλων και των μη μετάλλων μπορούν να χρησιμοποιηθούν για να τα ξεχωρίσουν.
Φυσικές ιδιότητες μετάλλων:
- Λαμπερό (γυαλιστερό)
- Καλός αγωγοί θερμότητας και ηλεκτρισμού
- Υψηλό σημείο τήξης
- Υψηλή πυκνότητα (βαρύ για το μέγεθός τους)
- Ελαφρύ (μπορεί να σφυρηλατηθεί)
- Όλκιμο (μπορεί να τραβηχτεί σε σύρματα)
- Συνήθως στερεό σε θερμοκρασία δωματίου (εξαίρεση είναι ο υδράργυρος)
- Αδιαφανές ως λεπτό φύλλο (δεν μπορεί να δει μέσα από μέταλλα)
- Τα μέταλλα είναι ηχητικά ή κάνουν ήχο σαν κουδούνι όταν χτυπηθούν
Χημικές ιδιότητες μετάλλων:
- Έχετε 1-3 ηλεκτρόνια στο εξωτερικό κέλυφος κάθε ατόμου μετάλλου και χάστε εύκολα ηλεκτρόνια
- Διαβρωτικά εύκολα (π.χ., κατεστραμμένα από οξείδωση, όπως αμαυρώσεις ή σκουριά)
- Χάστε εύκολα ηλεκτρόνια
- Σχηματίζουν οξείδια που είναι βασικά
- Φέι χαμηλότερες ηλεκτρογονικότητες
- Είναι καλοί αναγωγικοί παράγοντες
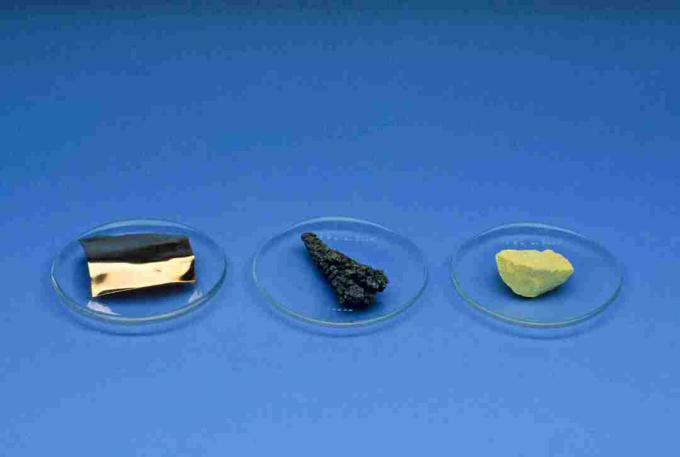
Αμέταλλα
Αμέταλλα, με εξαίρεση το υδρογόνο, βρίσκονται στη δεξιά πλευρά του περιοδικού πίνακα. Στοιχεία που είναι μη μέταλλα είναι υδρογόνο, άνθρακας, άζωτο, φώσφορος, οξυγόνο, θείο, σελήνιο, όλα τα αλογόνα και τα ευγενή αέρια.
Μη μεταλλικές φυσικές ιδιότητες:
- Όχι λαμπερό (θαμπή εμφάνιση)
- Κακοί αγωγοί θερμότητας και ηλεκτρικής ενέργειας
- Μη αγωγά στερεά
- Εύθραυστα στερεά
- Μπορεί να είναι στερεά, υγρά ή αέρια σε θερμοκρασία δωματίου
- Διαφανές ως λεπτό φύλλο
- Τα μη μέταλλα δεν είναι ηχητικά
Μη μεταλλικές χημικές ιδιότητες:
- Συνήθως έχουν 4-8 ηλεκτρόνια στο εξωτερικό τους κέλυφος
- Αποκτήστε ή μοιραστείτε εύκολα ηλεκτρόνια σθένους
- Σχηματίζουν οξείδια που είναι όξινα
- Εχω υψηλότερες ηλεκτρογονικότητες
- Είναι καλοί οξειδωτικοί παράγοντες
Τόσο τα μέταλλα όσο και τα μη μέταλλα έχουν διαφορετικές μορφές (αλλοτροπές), οι οποίες έχουν διαφορετικές εμφανίσεις και ιδιότητες μεταξύ τους. Για παράδειγμα, ο γραφίτης και το διαμάντι είναι δύο αλλότροπες του μη μεταλλικού άνθρακα, ενώ ο φερρίτης και ο ωστενίτης είναι δύο αλλότροπες σιδήρου. Ενώ τα μη μέταλλα μπορεί να έχουν ένα αλλότροπο που φαίνεται μεταλλικό, όλα τα αλλοτρόπα των μετάλλων μοιάζουν με αυτό που θεωρούμε ως μέταλλο (λαμπερό, γυαλιστερό).